Calorimétrie
1) Soit le chlorure d'hydrogène (un gaz) dont on connaît l'enthalpie de formation : ΔH°f HCl (g) = - 91,85 kJ/mol
En outre, on sait que l'enthalpie de formation de HCl en solution aqueuse vaut :
ΔH°f HCl (aq) = - 4,582 kJ/g
Calculer l'enthalpie molaire standard de dissolution de HCl dans l'eau. Cocher la bonne réponse.
2) Un système thermodynamique qui n'échange ni matière, ni énergie avec son entourage est appelé fermé.
3) Pour la réaction chimique 1 A(s) + 2 B(g) ![]() 1 C(g) + 3 D(g), l'expression littérale de la variation de l'enthalpie s'écrit : ΔH°réaction = [3ΔHf°(D) + 1ΔHf°(C)] - [1ΔHf°(A) + 2ΔHf°(B)].
1 C(g) + 3 D(g), l'expression littérale de la variation de l'enthalpie s'écrit : ΔH°réaction = [3ΔHf°(D) + 1ΔHf°(C)] - [1ΔHf°(A) + 2ΔHf°(B)].
4) L'énergie interne du système est une fonction d'état.
5) La capacité calorifique molaire d'un composé est la quantité de chaleur que l'on doit fournir à une mole de ce composé pour augmenter sa température d'un degré Celsius.
6) A pression constante, la capacité calorifique molaire s'écrit : Cp = ΔH/ΔT°
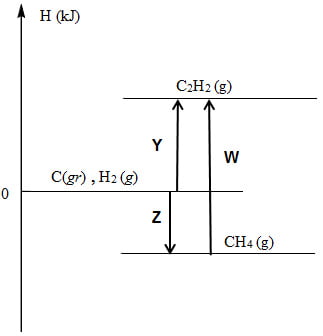
7) Connaissant les enthalpies standard de formation (ΔH°f) de l'éthyne (ou acétylène : C2H2) et du méthane (CH4) (ΔH°f C2H2(g) = 227 kJ/mol, ΔH°f CH4(g) = - 75 kJ/mol.
Complétez le diagramme enthalpique de la réaction : on doit y retrouver toutes les données enthalpiques du problème ainsi que la réponse.
Actuellement veuillez naviguer du dernier exercice vers le premier (flèche gauche uniquement).



 (Ariane Lejeune) Copyright: UCL - FUNDP © 2012–
(Ariane Lejeune) Copyright: UCL - FUNDP © 2012–
 Cette oeuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Partage à l'Identique 2.0 Belgique.
Cette oeuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution - Pas d'Utilisation Commerciale - Partage à l'Identique 2.0 Belgique.